- 237 Okunma
- 0 Yorum
- 0 Beğeni
Ekstrem Termofil Bakterilerin Protein Yapıları ve Termostabilizasyon Mekanizmaları
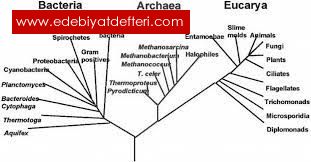
Stabilite, ekstrem koşullar altında belirlenmiş, fonksiyonel bir durumun muhafazası olarak tanımlanmaktadır (1, 2). Termostabilite ise, bütün proteinlerde bulunan kanonikal güçlerin modifikasyonuyla, örneğin elektrostatik (hidrojen bağları ve iyon çiftleri) ve hidrofobik etkileşimler ve bazı aminoasitlerin değişimiyle elde edilen birçok küçük yapısal modifikasyonlar ile kazanılan özellikler olarak tanımlanmaktadır. Protein termostabilitesi özel bir aminoasidin varlığına veya sentez sonrası modifikasyonuna bağlanamayan bir özelliktir (3). Protein termostabilitesi, hem bilimsel hem de endüstriyel alanlarda büyük öneme sahip olmasına, teorik ve deneysel araştırmaların temelini oluşturmasına karşın, henüz kısmen anlaşılabilmiş durumdadır.Termal stabilitenin fizikokimyasal prensiplerinin anlaşılmasının, protein katlanması ve protein etkileşim mekanizmalarını kavranılmasına yardımcı olacağı düşünülmektedir (4). Ekstrem termofiller veya ekstremofiller, özellikle volkanik kayaçlarda, kutup bölgelerindeki düşük sıcaklıklarda, derin denizlerdeki yüksek basınçta, çok düşük ve yüksek pH değerlerinde (pH 0-12) veya çok yüksek tuz konsantrasyonlarında (%5-30) yaşama olmuş mikroorganizmalardır (5, 6). Bu özel mikroorganizmalar, farklı alanlardan bilim adamlarının ilgisini uyandırmaktadır ve bu ilgi son yıllarda giderek artmaktadır (7). Özellikle de protein kimyacılar, protein termositabilitesini çalışmalarında kullanılan termostabil proteinlerin önemli bir kaynağı olan bu mikroorganizmalarla, çok fazla ilgilenmektedirler (8). Son zamanlarda ekstremofillerin, protein stabilizasyon mekanizmaları üzerine yapılan çalışmaların arttığı gözlenmektedir (9). Termal denaturasyona karşı, ekstrem termofil organizmaların proteinlerinin çalışılması, protein stabilizasyonu için yeni stratejilerin geliştirilmesine yardımcı olmaktadır (10).
Gerçekte protein stabilizasyon mekanizmaları hakkında bilgilerin büyük çoğunluğu, model enzim çalışmalarından elde edilmektedir. Birçok protein stabilizasyon mekanizması (örneğin; hidrofobik etkileşimler, paketlenme yoğunluğu, tuz köprüleri, hidrojen bağları, açılma entropisinin azaltılması, α- heliks stabilizasyonu, ilmik stabilizasyonu ve kovalent yıkıma direnç) model enzimler kullanılarak yapılan stabilite çalışmalarından elde edilmiştir (11). Ekstremofillerden elde edilen enzimler yani ekstremozimler (5, 6, 12-15), üzerine yapılan çalışmalar giderek artmaktadır, çünkü ekstremozimler protein termostabilitesi çalışmalarında (11), deterjan üretimi, gıda ve nişasta işlenmesi, yüksek fruktozlu mısır şurubu üretimi ve PCR uygulamaları gibi, çeşitli endüstriyel uygulamalar için yararlı olabilmektedirler (16). Son zamanlarda ekstremofilik adaptasyon üzerine yapılan çalışmalardaki ilerleme 4 sebepten kaynaklanmaktadır: keşfedilen ekstrem termofil sayısındaki artış, yeni genetik metotlar, tam genom dizilerinin eldesi ve 3 boyutlu protein yapıları ve bunların termal stabiliteleri üzerine yapılan çalışmalardaki artıştır (17). Biyomoleküllerin ekstrem şartlara adaptasyonundaki asıl mekanizma, stabilite ve elastikiyet arasında bir anlaşma sonucunda, fonksiyonel durumların korunmasıdır (18-20). Protein termostabilitesi çalışmalarında mutasyon deneyleri, yapısal analizle tanımlanan etkileşimlerin önemini deneysel olarak test etmek için kullanılmaktadır (3). Günümüzde mevcut termofil protein yapılarının analizi, termal stabilite mekanizmalarıyla ilgili ileri sürülen fikirlerin çoğunu desteklemektedirler, buna karşın proteinlerin termal stabiliteleriyle ilgili cevaplanamayan sorular bulunmaktadır (21). Ayrıca bilinen protein termostabilitesinin en üst sınırına ulaşan termostabil enzimlerin kullandıkları mekanizmalarda hala tam anlamıyla anlaşılabilmiş değildir (11). Sonuçta, hipertermofil proteinlerinin karşılaştırmalı analizi, protein stabilizasyonu için bazı çözümler sunmakta, ancak genel bir kural belirtmemektedir ve bu konuda cevaplanmamış bir çok soru bulunmaktadır (3). Ekstrem Çevreler ve Genel Özellikleri Dünya üzerindeki yaşam çok büyük bir adaptasyon kapasitesine sahiptir: volkanik hareketlerin merkezi hariç, dünyanın dış yüzeyi (derin denizlerin dipsiz gibi görünen bölgelerinden, Himalaya ların da dahil olduğu yüksekliklere kadar) biyosferi oluşturmaktadır (1, 2). Kantitatif açıdan bakıldığında, günümüzde biyolojik çevreye etkili fiziksel değişkenlerin bilinen sınırları; -40 o C<T< +115 o C (sırasıyla stratosferde ve hidrotermal deliklerde), p≤120MPa (derin denizlerdeki hidrostatik basınç için), aw ≈ 0.6 (tuz göllerindeki su aktivitesi için), 1<pH100bar basınca ulaşan alanlarda, kayalıkların parçalanmasıyla oluşan bölgeler ve dünyanın iç kısımlarındaki derinlikler gibi beklenmedik yerlerde yaşayan organizmalar olduğu bilinmektedir (23). Ekstrem termofiller veya ekstremofiller, özellikle volkanik basınçta, çok düşük ve yüksek pH değerlerinde (pH 0-12) veya kayaçlarda, kutup bölgelerindeki düşük sıcaklıklarda, derin denizlerdeki çok yüksek tuz konsantrasyonlarında (% 5-30) yaşama adapte olmuş mikroorganizmalardır (5, 6). Ekstremofiller olarak isimlendirilen mikroorganizmalar, yaşadıkları çevrenin özelliklerine göre termofiller, asidofiller, alkalifiller, halofiller ve psikrofiller olarak beş sınıfa ayrılmaktadırlar (24). Ekstremofillerin üzerinde en çok araştırma yapılan grubunun termofiller olduğu, termofillerin 45 o C den daha yüksek sıcaklıklarda kolaylıkla gelişebildikleri, 50-60 o C nin üzerindeki sıcaklıkları tolere edebilen çok hücreli hayvan, bitki ve mikrobiyel ökaryotlara henüz rastlanmadığı, 60 o C ve yukarısındaki sıcaklıklarda gelişen termofiller bilinmesine karşın ekstremofiller kapsamındaki termofillerin ilk olarak 30 yıl önce saptandığı (25), son 10- 15 yılda ise yüksek sıcaklıklarda gelişen birçok ekstremofilin izole edildiği bildirilmiştir (26). Termofilik bakteriler, yüksek sıcaklıkta yaşayabilme yeteneğine sahip, oksijen isteklerine göre anaerob veya fakültatif anaerob olabilen, Gram negatif, çubuk, disk yada eliptik morfolojilere sahip mikroorganizmalar olarak tanımlanmaktadırlar (27, 28, 29). 21 Termofillerin, 50-75 o C arasındaki sıcaklıklarda gelişenleri ekstrem termofiller ve 75- 105 o C arasında gelişenleri ise hipertermofiller olarak isimlendirilirler, her iki grup içerisinde bakteri ve arkeler de bulunabilirler (30, 31). Ekstrem koşullar altında yaşayan ekstremofillerin, bulundukları çevrelere göre sınıflandırılması aşağıdaki gibidir: Çizelge 1. Ekstremofiller ve çevreleri (32). Fenotip Çevre Mikroorganizma Termofiller 55-80 ºC Methanobacterium, Thermoplasma, Thermus Hipertermofiller 80-113 ºC Pyrococcus, Pyrolobus Psikrofiller (-2) - 20 ºC Alteromonas Halofiller 2- 5 M NaCl Haloarcula Asidofiller pH< 4 Sulfolobus Alkalifiller pH> 9 Natronococcus Termofilik mikroorganizmaların nişasta, selüloz, hemiselüloz ve proteinler gibi polimerleri hidrolize edebilen hücre dışı enzimleri ürettikleri belirtilmiştir (33). Özellikle, ekstrem termofilik (65- 85 o C gelişme sıcaklığı) ve hipertermofilik (85-110 o C gelişme sıcaklığı) mikroorganizma enzimlerinin poliaromatik ve alifatik hidrokarbonlarla, yağlar gibi hidrofobik substratlar ve nişasta, selüloz, hemiselüloz ve proteinler gibi polimerik bileşikleri parçalayabilmelerinden dolayı bunların ısıl kararlı ekstremozimleri ile süreçlerin 100 o C nin üzerindeki sıcaklıklarda yapılabileceği ve böylece kontaminasyon riskinin azalacağı belirtilmiştir (5). Ekstrem Termofil Bakterilerde Protein Yapıları Bütün proteinler, mezofilik ve ekstremofilik orijinlerinden bağımsız olarak, 20 standard daminoasitten oluşmaktadır (2, 34). Hücre sitosolünün multikomonent sisteminin artan sıcaklıklarda, basınç ve pH ekstremlerinde gereken kovalent modifikasyonların (deamidasyon, β- eliminasyon, disülfid değiştirme, oksidasyon, Maillard reaksiyonları, hidroliz vs. ) büyük çoğunluğunu uyguladığı bilinmektedir (19, 34). Ekstremofiller, hem uygun koruyucuları kullanarak hem de sentez ve tamir mekanizmalarını güçlendirerek aminoasit parçalanmasını engellemekte ve dolayısıyla protein stabilitesini korumaktadırlar (34, 35). Ekstremofillerin kimyaları hakkında çok az şey bilinmektedir, örneğin proteinlerin hidrotermal degradasyonu ve tamir mekanizmaları hakkında çok az şey bilinmektedir (1). 100 o C nin üzerindeki sıcaklıklar uygulandığında, yaygın aminoasitlerin termal stabiliteleri aşağıdaki gibi bulunmuştur (2, 36) ; (Val, Leu) > Ile> Tyr> Lys> His> Wet> Thr> Ser> Trp> (Asp, Glu, Arg, Cys) Hem standard aminoasitlerin hem de protein katlanması süresince, hidrofobik merkez oluşumu mikroorganizmanın yaşamı için gerekmektedir (36). 22 45 o C ve 110 o C arasındaki sıcaklıklarda gelişen, ekstrem termofil ve hipertermofil mikroorganizmalar tarafından üretilen proteinler, genellikle termal ve kimyasal denaturasyona karşı benzer protein yapısına sahip olan mezofilik homologlarından daha dirençlidirler (3, 23, 37). Bununla birlikte, mezofil ve termofillerde (veya hipertermofil) oluşan aynı proteinlerin bir çifti verildiğinde, hangisinin mezofillere hangisinin ekstrem termofillere ait olduğunu söylemek 3 boyutlu yapıları da aynı olduğu halde çok zor görünmektedir. Termostabil proteinler, yüksek sıcaklıklarda stabil ve aktiftirler, ancak bunların mezofil homologlarındaki proteinlerden daha stabil olduğunu gösteren belirgin bir özellikleri yoktur (2, 9, 23, 37). Termofil ve mezofil proteinlerin aminoasit analizi bile farklılıkları belirlemede işe yaramamaktadırlar (2, 23, 37). Ekstrem termofil ve hipertermofil proteinlerinin, stabilite artışını nasıl gerçekleştirdikleri günümüzde en çok çalışılan konulardan birisini oluşturmaktadır (37). Protein (termo) stabilitesinin yapısal temeli, proteinlerin 3 boyutlu yapılarına dayandırılarak zamanımızda iki yöntemle açıklanabilmektedir. Bunlar; -Kontrollü mutasyon (site- directed) ile elde edilen mutasyonların fizikokimyasal özelliklerinin analizi. -Mezofil ve termofil kaynakların, homolog proteinlerinin 3 boyutlu yapısının karşılaştırmalı analizi. Kısacası protein termostabilitesinin yapısal temelini anlamak için, aynı cinse ait mezofil ve termofil proteinlerinin 3 boyutlu yapısının karşılaştırmalı analizi ve kontrollü mutasyonla elde edilen mutantların protein yapılarının incelenmesi yeterli olmaktadır (1, 3). Yüksek veya düşük gelişme sıcaklıklarında, gelişmeye devam edildiğinde termofil proteinlerinde çeşitli adaptasyon mekanizmaları ortaya çıkmaktadır. Bunlar; iyon çiftlerinin (alt üniteler arası ve alt üniteler içi) kümelenmesi, hidrofobik merkez paketlenmesinin düzenlenmesi (van der Waals etkileşimlerinin artırılması) hidrojen bağları ağ ilavesi ve sekonder yapıda artma eğilimi, heliks dipol stabilizasyonunda artış, polar dış yüzey alanında artış, boşlukların toplam hacmi ve sayısındaki azalış, hem ilgili bölge içi (interdomain) ve alt ünite içi bağlantıların sıkılaştırılmasıyla, hem de ilişkili durumun artırılmasıyla hidrofobik dış yüzey alanı örtülmektedir. Adaptif değişimlerin hepsinin ortak paydası, verilen proteinin fonksiyonel durumunun korunması ve optimize edilmesine yöneliktir (1). Proteinlerin uzaysal yapısı, non- polar rezidülerle, hidrofobik etkileşimlerle, polar ve iyonize gruplar arasındaki elektrostatik güçlerle tanımlanmaktadır (1, 19, 21). Gibbs stabilizasyon serbest enerjisi (∆Go stab) büyük globular proteinler için 50 kj.mol-1 düzeyindedir (38). Bu yönden, ekstremofillerin proteinleri mezofilik homologlarından çok farklı değildir. Ekstremofil proteinlerinin hem iç hem de dış faktörlerle etkileşimleri süresince adaptasyonlarına ∆Go stab daki 10 ve 100 kj.mol-1 arasındaki artış eşlik etmektedir (39). Ekstremofil proteinlerinin iç etkilerle stabilizasyonunda, polipeptid zincirinin lokal paketlenmesi, sekonder ve süpersekonder yapısal elementler, ilgili bölgeler (domains) ve alt üniteler (subunit) gibi, protein yapı hiyerarşisinin bütün düzeyleri 23 gerekebilmektedir (34, 40, 41, 42, 43, 44). Ekstremofil proteinleri için elde edilen ∆∆G N U değeri, mezofil proteinleri için bulunan ∆∆G N U ile aynı büyüklüktedir (39). Termofil proteinlerin, termal stabilitesinin 2 önemli yanı vardır; 1. Yaygın akademik soruların örneğin protein katlanması ve termal stabilitenin fiziksel prensiplerini anlamamıza yardımcı olmaktadır. 2. Endüstride ve protein mühendisliği çalışmalarında büyük öneme sahip, proteinlerin termal stabilitesinden sorumlu olan trafik kurallarını tanımlamasıdır (45, 46). Mezofil, Termofil ve Ekstrem Termofil Proteinler Arasındaki Yapısal Farklılıklar ve Termostabiliteye Etkileri Aynı aileye ait olan, mezofil ve termofil proteinlerinin 3 boyutlu yapılarının karşılaştırılması, protein termostabilitesinin yapısal temelini anlamamıza yardımcı olmaktadır (3). Farklı termal stabiliteye sahip homolog protein çiftlerinin karşılaştırılması, termal adaptasyon mekanizmalarını anlamak için sıkça kullanılmaktadır (39). Mezofil, termofil ve ekstrem termofil homolog proteinlerinin dizileri ve dördüncül yapıları karşılaştırıldığında, en önemli farklılık iyon çiftlerinin sayılarında bulunmuştur. Termofil proteinlerinde, zayıf iyon çiftlerinin, ekstrem termofil proteinlerinde ise güçlü iyon çiftlerinin sayılarında önemli bir artış gözlenmektedir. İyon çiftleri özellikle ekstrem termofillerin termal stabilizasyonunda anahtar rol oynamaktadır (37). Argos ve meslektaşları (4, 47), 19 termofil ve 37 mezofil organizmanın protein yapısını içeren bir veri seti oluşturarak hidrojen bağları ve tuz bağlantılarının tipi ve miktarı, polar yüzey komposizyonu, iç boşluklar, paketleme yoğunluğu ve sekonder yapıları analiz etmişlerdir. Çalışmanın sonucunda, termofillerde termostabilitedeki artışa bağlı olarak iç hidrojen bağları ve tuz köprülerinde bir artış gözlendiğinde, ilave olarak polar yüzey fraksiyonu ve sekonder yapı içeriğinde de artışlar olduğu gözlenmiştir (37). Ekstrem termofil proteinleri, termofil proteinleriyle karşılaştırıldığında, termal stabilite mekanizmalarının farklı olduğu gözlenmektedir. Bununla birlikte ekstrem termofil organizmalara ait protein yapılarının sınırlı miktarı, kesin bir sonuç çıkartılmasına engel olmaktadır. Mezofil homologlarıyla karşılaştırıldığında, ekstrem termofil proteinlerindeki boşluk oranında önemli bir azalma gözlenirken, termofillerde boşluk oranında önemli bir değişiklik görülmemektedir. Termofil proteinlerinde, ekstrem termofil proteinlerinde gözlenmeyen dış yüzey polaritesi daha fazladır. Termofil proteinlerinin hepsinin α- heliks ve β- yaprak fraksiyonlarında (düzensiz bölgelerdeki azalışa karşılık) önemli bir artış olduğundan bahsedilmektedir. Termofil proteinlerde α- heliks, ekstrem termofillerde ise β- yaprak yapısındaki artış daha yaygındır (37). 24 Protein termostabilitesi, diğer hidrojen bağlarından daha önemli olduğu düşünülen, yüklü ve nötral yan zincirler arasında oluşan hidrojen bağlarının miktarıyla yakından ilişkilidir (48). Mezofil ve termofillerin çeşitli tetramerik GAPDH ları üzerinde yapılan araştırma termostabilite ve hidrojen bağlarının miktarı arasında açık bir korelasyon olduğunu ispatlamaktadır (48, 49). Termofil ve ekstrem termofil proteinleri karşılaştırıldığında, aminoasit komposizyonları farklılık göstermektedir. Ekstrem termofil proteinlerinde, Methionin ve Asparajin miktarlarındaki azalma, yüksek sıcaklıklarda bu aminoasit rezidülerinin kimyasal düzensizlikleriyle açıklanabilmektedir (37). Mezofil ve termofil proteinlerinin karşılaştırılması ile yapılan çalışmalarda (50), hidrofobik etkinin yüksek sıcaklıklarda arttığı, bununla birlikte bu etkinin termostabiliteye etkisinin elektrostatik etkileşimlerle karşılaştırıldığında çok fazla olmadığı gösterilmiştir (37). Termofil ve mezofil proteinlerindeki aminoasit dağılımı, protein yapıları arasındaki yüksek dizi homolojilerine rağmen baştan sona farklıdır. Termofil proteinleri mezofil homologlarıyla karşılaştırıldığında Arginin ve Tirozin önemli düzeyde artarken, Sistein ve Serin gibi termolabil rezidülerde önemli bir azalma gözlenmektedir. Prolinin, termofil proteinlerinin α- helikslerinde daha az oluştuğu gözlenmektedir. Hem termofil hemde mezofil proteinlerinde hidrofobiklik, sıkılık, oligomerik durumlar, dış yüzey alanlarının polar ve non- polar katkıları, asıl zincir ve yan zincir hidrojen bağları benzemektedir. Diğer taraftan, tuz köprüleri ve yan zincir- yan zincir hidrojen bağları, termofil proteinlerinde fazladır (9). Termozim ve mesozimler arasında da termostabilite açısından bazı farklılıklar bulunmaktadır. Mesozimler, tipik olarak moleküler bozulmayı izleyen açılmayla inaktive olurlarken (örneğin, proteinlerin inaktif formlarının çökmesi), termozimler kovalent modifikasyonla inaktive olmaktadırlar. Termozimlerdeki ilmikler, mesozimdekilerden daha kısadır. Termozim ve mesozimlerin AGstab değerleri arasındaki fark, termozimlerdeki ilave hidrojen bağları tuz köprüleri ve hidrofobik etkileşimlerden kaynaklanmaktadır (11). İstatistiksel veriler, termozimlerin mesozimlerden daha yüksek Arginin: Lisin oranına sahip olduğunu göstermektedir. Arginin , yüksek sıcaklıklarda tuz köprülerini korumak için gerekli aminoasitlerin en önemlilerinden birisidir, çünkü Lisin den daha yüksek pKa ya sahiptir ve tipik olarak, pKa değerleri sıcaklıktaki artışla düşmektedir (51). Ayrıca termozimler, proteolizise mezozimlerden daha dirençlidirler (52), bu büyük olasılıkla yüksek katılığa sahip olmalarından kaynaklanmaktadır (9). Ekstrem Termofillerde Termal Stabilite ve Etkileyen Faktörler Yüksek sıcaklıklara evrimsel adaptasyonun en önemli yollarından birisi, proteinlerin termal stabilitelerini mutasyonlar aracılığıyla artırmalarıdır (19). Termostabilite ve yapısal parametreler arasındaki en güçlü korelasyon, elektrostatik etkileşimlerde gözlenmektedir, ancak diğer faktörlerde örneğin sekonder yapılar, boşluklar ve polar yüzey fraksiyonuda ayrıca termal stabiliteyle korelasyon göstermektedir. Termofil ve ekstrem termofil proteinlerinin yüksek stabilite için oldukça farklı mekanizmaları 25 kullandıkları görülmektedir. Buna sebep olarak, protein stabilizasyonunda gereken farklı güçlerin sıcaklığa bağımlılığı gösterilebilmektedir (37). Bakteriyel ve arkeal hipertermofiller, mezofil homologlarından önce geldikleri için, filogenetik ağacın köküne yakındırlar (53). Günümüzdeki analizler, mevcut hipertermofillerin yüksek sıcaklığa adaptasyon vasıtasıyla mezofillerden oluştuğunu desteklemektedir (54). Termostabilite, bütün proteinlerde bulunan kanonikal güçlerin modifikasyonuyla, örneğin elektrostatik (hidrojen bağları ve iyon çiftleri) ve hidrofobik etkileşimler ve bazı aminoasitlerin değişimiyle elde edilen birçok küçük yapısal modifikasyonlar ile kazanılan özelliklerdir (3). Ekstrem termofil proteinlerinin termal stabilitesi denilince, proteinlerin ekstrem koşullarda belirlenmiş fonksiyonel bir özelliğini koruyabilmesi anlaşılmaktadır (1, 2). Proteinlerde, katlanma, denaturasyon ve stabilite, birbirleriyle ilişkilidir ve stabiliteyi belirlemek için sadece polipeptid zincirinin doğal durumunun bilinmesi yeterlidir. Katlanmada, proteinin yapısal bileşikleri arasındaki etkileşimler, toplam ve sekansal etkiler, doğal durumun oluşumunda etkilidir. Proteinin doğal yapısının stabilitesi, fiziksel ve kimyasal koşullar altında, 3 boyutlu yapının korunması olarak tanımlanabilmektedir. Bir proteinin fonksiyonelliği, doğal yapısından kaynaklanmaktadır (3). Protein stabilitesi, ikiye ayrılmaktadır. Bunlardan, mikrostabilite, fonksiyonel proteinlerin termodinamik özelliklerini tanımlarken; makrostabilite proteinin katlanmış doğal yapısının bütünlüğünün korunmasından sorumludur. Bir proteinin termodinamik stabilitesi, doğal hali (N) ve denature hali (D) arasındaki serbest enerji değişim değeri (∆G N D) ile verilmektedir. Ayrıca fizyolojik koşullar altında, globuler proteinlerin konformasyonel stabilitesi, katlanmış (N) ve katlanmamış (D) durumlar arasındaki serbest enerji değişimi ile (∆GN D) tanımlanabilmektedir (22). Herhangi bir reaksiyonun serbest enerji değişim değeri, aşağıdaki gibi hesaplanabilmektedir: ( ∆GN D ) = GD -GN = ∆ H N D -T ∆ S N D Eğer proteinde sadece iki termodinamik hal araştırılıyorsa ve aşağıdaki duruma göre, denaturasyon oluşuyorsa, geçerli olan eşitlik aşağıdaki gibidir. Doğal Hal Denature Hal (∆G N D), konformasyonel stabilitenin direkt ölçümü ve herhangi bir proteinin termal stabilitesini kantitatif olarak tanımlamak için kullanılmaktadır (3). Globuler proteinlerin yapılarından, büyüklük ve denaturasyonlarından bağımsız olarak, daima ∆G= 5-17 kcal/mol aralığında stabilizasyon serbest enerjisi göstermektedirler (55, 56). Termolisinin yüksek kararlılıktaki kristal yapısı ilk kez, 1974 de incelenmiştir. Ardından ferrodoksin ve hemoglobin A2 nin termostabilitesinin stereokimyasal temeli üzerinde çalışmalar yapılmıştır. Protein termostabilite çalışmalarına öncülük eden bu 26 çalışmalardan sonra, araştırmacılar protein termostabilitesinin moleküler temelini anlamak amacıyla çalışmalarını sürdürmüşlerdir. Ekstrem termofil proteinlerinin yüksek termostabilitesinde rol alan fizikokimyasal faktörler aşağıdaki gibidir (57); -Hidrojen bağlarının artışı -Hidrofobik iç paketlerin artışı -Sekonder yapı oluşumunda artış -Heliks dipol stabilizasyonu -Oksidasyon ve deamidasyona hassas rezidülerin ayrılması -Gömülü hidrofobik alan artışı -Elektrostatik etkileşimlerin düzeltilmesi -İç alt üniteler arası bağlantıların güçlendirilmesi -Tuz köprülerinin optimizasyonu -van der Waals etkileşimlerinin artışı -Kalsiyuma olan ilginin artışı -Yer değiştirmeyle entalpinin düzenlenmesi -Sekonder yapıların stabilitesinin artırılması -Heliks yapının artışı ve polar dış yüzey alanının artışı -İlmiklerde prolinlerin artışı ve glisin azalması -Daha kısa ilmikler -Disülfid çapraz bağ ilavesi -İç boşlukların hacim ve sayılarındaki azalış -Aromatik etkilişimlerdeki artış -Sekonder yapıların içerisindeki ve dışarısındaki aminoasitlerin yer değiştirmesi
Ekstrem termofil bakterilerin, termal stabilitesinde rol alan bu faktörlerin bazılarının protein yapısına etkileri ve stabiliteye katkıları aşağıdaki gibi açıklanmaktadır. Paketlenme Yoğunluğu Protein merkezleri tipik olarak hidrofobik özellik göstermektedir ve proteinler merkezlerindeki hidrofobikliğin artışına bağlı olarak paketlenme yoğunluğu da artmaktadır. Bir proteindeki paketlenme yoğunluğu, proteinin sıkılığı hesaplanarak bulunabilmektedir. Ekstrem termofil proteinlerinin yüksek termal stabiliteye sahip olmaları, yüksek paketlenme yoğunluğu ve buna bağlı olarak daha küçük ve az miktarda boşluklar içermelerinden kaynaklanmaktadır (11). Hidrofobik Etkileşimler Hidrofobik etkileşimler protein katlanmasında, dolayısıyle protein stabilitesinde esas güçtür (58). Hidrofobik etkileşimlerin, proteinlere sulu çözeltilerde katlanma için gereken enerjiyi sağladıkları düşünülmektedir (11). Mezofilik homologlarından daha hidrofobik olan ekstrem termofil proteinlerinin, protein katlanması buna bağlı olarak da termal stabiliteleri daha fazla olmaktadır. Hidrofobik etki paketlenmede olduğu gibi, iki şekilde açıklanabilmektedir. Bunlar; 27 i. Protein zincirlerinin kendi içlerindeki hidrofobik etkileşimler, ii. Protein zincirleri arasındaki ilişkiden kaynaklanan hidrofobik etkileşimlerdir (37). Elektrostatik Etkileşimler (Hidrojen bağları ve iyon çiftleri) Ekstrem termofil proteinlerinde yürütülen termal stabilite çalışmalarında, hidrofobik iç paketlerin artışına bağlı olarak hidrojen bağ sayısının da arttığı ve bu artış sonucunda termal denaturasyona direncin arttığı gözlenmiştir. Üzerinde çalışılan temostabil proteinlerin hepsinde, iyon çiftleri ve hidrojen bağlarındaki artışın termal stabilite artışında önemli bir role sahip olduğu anlaşılmıştır (3). Aminoasit Yer Değiştirmeleri Ekstrem termofil proteinlerin, heliks yapılarında yer alan bazı aminoasitlerin yer değiştirmesi ile termal stabilitede artış olduğu, yapılan çalışmalarla belirlenmiştir. Proteinlerin heliks yapılarında gerçekleşen aminoasit yer değiştirmeleri, proteinin dış hidrofobikliğini azaltırken, iç hidrofobikliğini artırmaktadır. Buna bağlı olarakta artan iç hidrofobiklikle termal stabilite artmaktadır (59). Aminoasit yer değiştirmelerinin bir diğer işlevi de, helikslerin içerisine heliks stabilize edici yapıları taşımalarıdır. Termofilik proteinlerin, yer değiştirmelere bağlı olarak αheliks yapılarının hidrofobikliğinde artış ve elastikiyetlerinde azalış gözlenmekte ve proteinler sıkıca paketlenmektedirler. Termofilik proteinlerinde sıkça görülen aminoasit yer değiştirmelerinin diğer bir avantajı da, termal stabilitede önemli rol oynayan tuz köprüleri ve hidrojen bağlarının miktarını artırmalarından kaynaklanmaktadır (3). Kristallografik Parametreler Bir proteinin moleküler yüzey alanı polar, non- polar ve yüklü olarak sınıflandırılabilmektedir. Termofil proteinlerinde, non- polar ve yüklü yüzey alanları, polar örtülmüş yüzey alanları da ekstrem termofil proteinlerinde daha fazladır (60). Tuz Köprüleri Deneysel verilere göre, ekstrem termofil proteinlerini stabilize etmede yaygın etkileşimler olarak tuz köprüleri tanımlanmaktadır. Ekstrem termofillerdeki tuz köprüleri sekonder yapıyı stabilize etmektedirler. Ayrıca, Arginin yüksek sıcaklıklarda tuz köprülerini korumaktadır (11). Kovalent Modifikasyona Direnç Artan sıcaklıklarda oluşan kovalent modifikasyonlarla (Sistein yıkımı, Asparagin ve Glutamin deamidasyonu, Sistein oksidasyonu ve peptid bağlarının hidrolizi) 28 proteinlerin geri dönüşümsüz olarak denature etmektedir (51). Mezofil proteinleri moleküler bozulmayı izleyen açılmayla inaktive olurken, termofil proteinleri kovalent modifikasyonla inaktive olmaktadırlar. Termofil proteinlerinin stabilitelerindeki ve disülfid bağlarındaki artış, kovalent modifikasyona dirençlerini artırmaktadır (61, 62). İlmik Stabilizasyonu İlmikler, protein yapısının ısıya en hassas bölgeleridir.Termal denaturasyon boyunca açılma ilk olarak ilmiklerden başlamaktadır (11). Ekstrem termofil ilmikleri, mezofil homologlarından daha kısadır. İlmiklerdeki kısalmanın, protein sıkılığını artırdığı ve esnekliğini azalttığı bilinmektedir. İlmiklerin protein sıkılığı üzerine direk etkilerine ilave olarak, sekonder yapılar üzerinde stabilize edici etkiye sahiptirler (63). Termofil Proteinlerini Stabilize ve Destabilize Edici Faktörler 100 o C nin üzerindeki sıcaklıklar uygulandığında yaygın aminoasitlerin termal stabiliteleri aşağıdaki gibi olmaktadır; (Val, Leu ) > Ile > Tyr > Lys > His > Met > Thr > Ser > Trp > (Asp, Glu, Arg, Cys) 20 aminoasidin içinde Asparagin, Glutamin, Metiyonin ve Sistein yüksek sıcaklıklarda deamidasyon ve oksidasyona hassas olduklarından, termolabil olarak sınıflanmaktadırlar (64). Termofil proteinler, hidrojen bağları ve tuz köprüsü oluşumunu desteklemektedir. Geniş yan zincirlerinden dolayı, Arginin ve Tirozin hem kısa aralıklı hem de uzun aralıklı lokal etkileşimlerde yararlı olabilmektedirler. Arginin deki guanidin grubu, tuz köprüleri oluşturabilmektedir. Öte yandan Serin in R grubunun kısa olması nedeniyle lokal etkileşimlerde çok fazla rol oynar. Protein stabilitesine katkıları açısından Arginin ve Tirozin de Serin e benzer görevler yapar (4, 47, 57,60, 64). Açılma Entropisinin Azalması Proteinlerin 3 boyutlu yapılarını, açılma entropisinin azalmasıyla stabilitelerinin arttığı bilinmektedir. Proteinin açılması sırasında Glisin en yüksek konformasyonel entropiye sahip rezidüdür. Glisinin herhangi bir aminoasitle yer değiştirmesi (herhangi bir rezidü yerine Prolinle) proteinin açılma entropisini azaltmaktadır (11). Termal stabiliteyi etkileyen faktörlerin incelenmesi amacıyla, ekstrem termofil ve mezofil proteinleri arasında yapılan dizi karşılaştırmalarında, ekstrem termofil proteinlerin stabiliteyi artıran faktörleri tercih ederken, destabilize edici faktörlerden sakındıkları gözlenmiştir (9). Ekstrem Termofil Bakterilerde Protein Termostabilitesinin Önemi Ekstremofillerin, metabolik süreçleri ve tüm biyolojik işlevleri, ekstrem koşullarda aktif protein ve enzimler tarafından yürütülmektedir. Son yıllarda ekstremofillere 29 duyulan ilginin başlıca nedeni bunların ekstrem koşullarda gelişmeleri ve biyoteknolojik uygulamalarda kullanılan enzimleri üretebilmeleridir (26). Ekstremofillerden elde edilen enzimler yani ekstremozimlerin yüksek ısıl kararlılığa sahip ve deterjanlar, katotropik ajanlar, organik çözücüler ve ekstrem pH gibi koşullara dirençli oldukları bildirilmiştir (5, 6, 12-15). Ayrıca bazı ekstremozim proteinlerinin termostabil endüstriyel enzimler üretiminde model olarak kullanılabilecekleri de belirtilmiştir (5, 6). Ekstrem termofil ve hipertermofil arke ve bakteriler tarafından üretilen enzimlere termozimler denilmektedir. Termozimler, 60 o C ve 125 o C arasında optimum olarak fonksiyon gösterebilen enzimlerdir (11). Yüksek biyoteknolojik potansiyellerinden dolayı, son yıllarda sıcaklık optimumları, 60 o C ve 125 o C aralığı olan termozimlere olan ilgi artmıştır. Termozimler, moleküler biyolojide (Taq polimeraz), deterjan (proteaz) ve nişasta (α- amilaz, glukoz izomeraz) endüstrileri ve proteinlerin yüksek stabilitesini gerektiren uygulamalarda kullanılmaktadırlar (11). Sonuç olarak termozimler, gıda, deterjan, kimya ve ilaç endüstrisindeki tepkimeleri optimize ettiği ve bazı termozimler endüstriyel uygulamalarda kullanıldığı için büyük bir öneme sahiptirler. Termal stabilite üzerine yürütülen farklı çalışmalardan, ekstrem termofil bakterilerin proteinlerinin termal stabilite artışının temelini oluşturan, yapısal özellikler hakkında genel bir sonuca varmak oldukça zordur.Protein Data Bank ındaki yapıların sayısının hızla artış, mevcut protein yapılarının analizinin sürmesi ve atomik koordinatlardan hesaplanabilen bazı yeni özellikler ve yeni ölçüm teknikleriyle termal stabilite üzerindeki çalışmalar hızlanmış ve yeni bilgiler elde etmek için çalışmalar sürmektedir (37).
YORUMLAR
Henüz yorum yapılmamış.
 KİTAP
KİTAP MÜZİK
MÜZİK ATÖLYE
ATÖLYE